Trở về Mục lục cuốn sách
Các khái niệm cơ bản
4-1 Các phản ứng tự phát.
4-2 Cân bằng và hệ số cân bằng. Tốc độ phản ứng. Các phản ứng thuận và nghịch.
4-3 Dạng tổng quát của hằng số cân bằng. Định luật tác dụng khối lượng.
4-4 Áp dụng hằng số cân bằng. Hệ số phản ứng, Q, và tiêu chuẩn để phản ứng tự phát. Các nồng độ cân bằng.
4-5 Các đơn vị và hằng số cân bằng,
4-6 Cân bằng liên quan tới thể khí với thể lỏng hoặc rắn. Áp suất hơi.
4-7 Những nhân tố ảnh hưởng tới cân bằng. Nguyên lý Le Chatelier. Ảnh hưởng của nhiệt độ, áp suất, và chất xúc tác.
Và như vậy, chẳng có vật gì trên thế giới xuất hiện
Hay biến đi hoàn toàn,
Bởi tự nhiên đã
Dựng nên thứ này từ tàn tro của thứ khác;
Chẳng có gì tự nó sinh ra
Mà không từ cái chết của vật khác.Lucretius (95-55 TCN)
Câu hỏi chủ yếu được đặt ra ở Chương 2 là “Nếu như một tập hợp các chất cho trước sẽ phản ứng để cho ra sản phẩm mong muốn, thì sẽ cần lượng từng chất bằng bao nhiêu?” Giả thiết cơ bản đã được đặt ra là vật chất không thể được tạo ra hay triệt tiêu một cách tùy tiện, và nguyên tử tham gia vào phản ứng phải đi ra dưới dạng sản phẩm.
Trong chương này ta đặt ra câu hỏi thứ hai: “Nhưng phản ứng sẽ xảy ra chứ?” Liệu có một xu hướng hay động lực để giúp cho phản ứng cho trước xảy ra, và nếu ta đợi đủ lâu thì ta sẽ thấy các chất tham gia sẽ chuyển thành sản phẩm một cách tự phát hay không? Câu hỏi này dẫn đến các ý tưởng về tính tự phát và cân bằng hóa học. Một câu hỏi thứ ba, “Liệu một phản ứng có xảy ra trong một thời gian tương đối ngắn không?” sẽ liên quan tới động học phản ứng, và sẽ được thảo luận ở Chương 22. Còn bây giờ, ta sẽ thỏa mãn nếu như dự đoán được cách mà phản ứng hóa học sẽ tự xảy ra, và tạm thời bỏ qua yếu tố thời gian.
4-1 Các phản ứng tự phát
Một phản ứng hóa học mà sẽ tự diễn ra, miễn là có đủ thời gian, thì được gọi là phản ứng tự phát. Ngoài không khí, bà dưới các điều kiện bên trong động cơ xe hơi, phản ứng cháy của xăng là tự phát:
C7H16 + 11O2 → 7CO2 + 8H2O
(Phản ứng này là phản ứng tỏa nhiệt. Mức thay đổi enthalpy, vốn đã định nghĩa từ Chương 2, khá lớn và có giá trị âm: ΔH = −4812 kJ mol-1 với heptan ở 298 K. Lượng nhiệt tỏa ra khiến cho các sản phẩm khí giãn nở, và chính áp xuất từ những khí giãn nở này đã đẩy xe hơi chạy.) Ngược lại, phản ứng ngược dưới cùng điều kiện lại không phải tự phát:
7CO2 + 8H2O −×→ C7H16 + 11O2
Không ai nghiêm túc lại đi nói rằng xăng có thể thu được một cách tự phát từ một hỗn hợp hơi nước và cacbon đi-oxit.
Các vụ nổ là ví dụ cho phản ứng tự phát, nhanh chóng, nhưng một phản ứng không cần phải xảy ra nhanh chóng như vụ nổ mới được gọi là tự phát. Điều quan trọng là phải hiểu rõ sự khác biệt giữa độ nhanh và tính tự phát. Nếu bạn trộn oxy và hydro tại nhiệt độ khí trong phòng, thì chúng vẫn tồn tại bên cạnh nhau mà không có phản ứng gì đáng kể trong cả thời gian dài hàng năm trời. Song phản ứng này để tạo thành nước đích thực là phản ứng tự phát:
2H2 + O2 → 2H2O
Ta biết rằng điều này đúng vì ta có thể châm ngòi cho phản ứng này bằng một que diêm, hoặc một chất xúc tác là kim loại platin nghiền nhỏ.
Câu văn trên cho ta thấy nguyên do mà nhà hóa học quan tâm đến liệu một phản ứng có tự phát hay không, nghĩa là phản ứng này có xu hướng tự nhiên để xảy ra không. Một phản ứng hóa học mong muốn nếu tự phát nhưng chậm, thì có khả năng làm nhanh quá trình phản ứng được. Thường thì tăng nhiệt độ sẽ giải quyết được vấn đề, hoặc chất xúc tác có thể phát huy tác dụng. Ta sẽ bàn kĩ về chức năng của chất xúc tác ở Chương 22. Còn bây giờ, có thể nói ngắn gọn là chất xúc tác là hóa chất giúp một phản ứng vốn có bản chất tự phát xảy ra nhanh hơn nữa, qua việc đưa ra một đường dẫn thuận tiện hơn cho phản ứng. Xăng sẽ đốt cháy nhanh chóng trong không khí ở nhiệt độ đủ cao. Vai trò của chiếc bu-gi trong động cơ xe hơi là để cung cấp nhiệt độ ban đầu này. Lượng nhiệt tạo ra từ phản ứng sẽ duy trì nhiệt độ cao cần để nó tiếp diễn. Xăng sẽ kết hợp với oxi tại nhiệt độ phòng nếu ta dùng chất xúc tác thích hợp, bởi phản ứng là tự phát nhưng chậm. Song sẽ không có chất xúc tác nào khiến cho cacbon đi-oxit kết hợp lại được với nước để tạo nên xăng và oxy ở nhiệt độ phòng và áp suất vừa phải, và nhà hóa học sẽ rất ngốc nghếch nếu dành thời gian để cố gắng tìm kiếm một chất xúc tác như vậy. Nói tóm lại, sự hiểu biết về các phản ứng tự phát và không tự phát sẽ giúp cho nhà hóa học thấy được giới hạn của những gì có thể được. Nếu như một phản ứng có thể nhưng đang chưa hiện thực hóa được, thì có lẽ vẫn đáng cất công tìm ra cách tiến hành nó. Còn nếu quá trình tự nó là không thể được, thì đã đến lúc ta cần phải nghiên cứu điều gì đó khác.
4-2 Cân bằng và hằng số cân bằng
Tốc độ diễn ra của phản ứng thường phụ thuộc vào các nồng độ của các chất tham gia phản ứng. Đây là cách suy luận chung, bởi đa số các phản ứng đều xảy ra khi các phân tử va chạm với nhau, và càng có nhiều phân tử trong một đơn vị thể tích, thì số vụ va chạm sẽ xảy ra thường xuyên hơn.
Cách cố định ni-tơ khí quyển dùng trong công nghiệp là rất quan trọng trong sản xuất phân bón nông nghiệp (và cả thuốc nổ). Một trong trong các bước của quá trình cố định ni-tơ, khi có chất xúc tác, là
N2 + O2 → 2NO (4-1)
Nếu như phản ứng này xảy ra bằng sự va chạm đơn giản giữa một phân tử N2 và một phân tử O2, thì ta sẽ dự kiến rằng tốc độ va chạm (và từ đó, tốc độ phản ứng) phải tỉ lệ thuận với các nồng độ của N2 và O2:
Tốc độ tạo ra NO tỉ lệ thuận với [N2][O2].
hay
R1 = k1[N2][O2] (4-2)
Hằng số tỉ lệ k1 được gọi là hằng số tốc độ phản ứng thuận, còn các đại lượng trong ngoặc vuông, [N2] và [O2] biểu diễn nồng độ tính theo mol trên lit. Hằng số tốc độ này, mà ta sẽ thảo luận kĩ hơn ở Chương 22, thường thay đổi theo nhiệt độ. Đa số các phản ứng diễn ra nhanh hơn ở nhiệt độ cao hơn, bởi vậy k1 lớn hơn ở nhiệt độ cao. Nhưng k1 không phụ thuộc vào nồng độ của các khí ni-tơ và oxy có mặt. Tất cả sự phụ thuộc nồng độ của tốc độ tổng thể phản ứng thuận, R1, đã nằm ở các đại lượng [N2] và [O2] rồi. Nếu như phản ứng này bắt đầu nhanh chóng trong một bể chứa đậy kín với các nồng độ khởi đầu của hai khí đều rất cao, thì khi càng nhiều khí N2 và O2 bị tiêu thụ, phản ứng thuận sẽ dần chậm lại. Tốc độ phản ứng sẽ giảm vì tần số va chạm của các phân tử sẽ dần hạ xuống khi còn ít phân tử N2 và O2 còn trong bể.
Phản ứng ngược lại cũng có thể xảy ra. Nếu như phản ứng này được tiến hành do va chạm giữa hai phân tử NO để tạo thành một phân tử của mỗi khí ban đầu,
2NO → N2 + O2 (4-3)
thì tốc độ phản ứng một lần nữa lại sẽ tỉ lệ với nồng độ của từng phân tử va chạm. Vì những phân tử này là của cùng một hợp chất, NO, nên tốc độ này sẽ tỉ lệ với bình phương của nồng độ NO:
Tốc độ tiêu hao NO tỉ lệ thuận với [NO][NO]
hay
R2 = k2[NO]² (4-4)
trong đó R2 là tốc độ tổng thể phản ứng nghịch còn k2 là hằng số tốc độ phản ứng nghịch. Nếu như có rất ít NO khi thí nghiệm bát đầu thì phản ứng nghịch này sẽ xảy ra với tốc độ không đáng kể. Nhưng khi NO tích tụ dần qua phản ứng thuận, thì nó sẽ càng bị phá hủy nhanh hơn bởi phản ứng nghịch.
Do đó khi tốc độ thuận, R1, giảm đi thì tốc độ nghịch, R2, tăng lên. Cuối cùng sẽ đạt tới điểm mà các phản ứng thuận và nghịch cân bằng với nhau:
. R1 = R2
[N2][O2] k1 = k2 [NO]2 (4-5)
Đây là điều kiện cân bằng. Nếu bạn theo dõi nồng độ của ba chất khí này, N2, O2, và NO, bạn có thể đã thấy được rằng thành phần của hỗn hợp phản ứng đã đạt tới một trạng thái cân bằng và từ sau đó thì không thay đổi theo thời gian nữa. Điều này không có nghĩa là từng phản ứng riêng đã ngừng là, mà chỉ là chúng đang diễn ra với tốc độ như nhau; nghĩa là chúng đã đạt đến, và sau đó duy trì ở một điều kiện cân bằng.
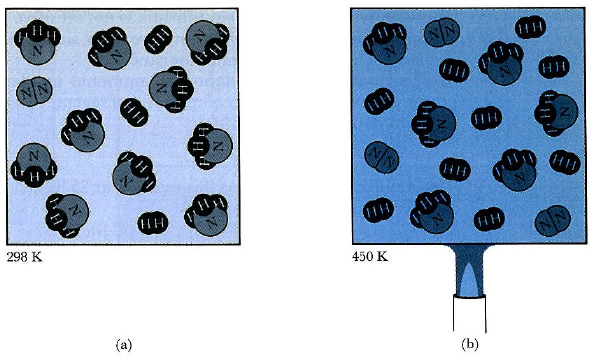
Điều kiện cân bằng có thể được minh họa qua cách tưởng tượng hai bể cá lớn, được nối với nhau mởi một đường ống (Hình 4-1). Ban đầu, một bể chứa 10 con cá vàng, còn bể kia chứa 10 con cá bảy màu. Nếu bạn dành thời gian đủ lâu để xem những con cá bơi tung tăng, thì cuối cùng bạn sẽ thấy rằng có khoảng 5 con cá ở từng bể. Mỗi con cá có cùng khả năng bơi nhầm vào bể kia qua ống. Nhưng miễn là khi có nhiều cá vàng ở bể trái hơn (Hình 4-1a) thì xác suất rằng có cá vàng bơi từ trái sang phải sẽ lớn hơn xác suất có cá vàng bơi ngược lại. Tương tự, miễn là khi cá bảy màu có ở bể phải nhiều hơn bể trái, thì tính tổng hợp sẽ có dòng cá bảy màu di chuyển về phía trái, mặc dù bể trái cũng chẳng có gì đặc biệt để hấp dẫn cá bảy màu cả. Như vậy tốc độ chuyển động của dòng cá bảy màu thì tỉ lệ thuận với mật độ của cá bảy màu hiện có. Một phát biểu tương tự cũng dành cho cá vàng.

Hình 4-1. Minh họa cân bằng động: hai bể cá được nối bởi một đường ống. (a) Lúc bắt đầu thí nghiệm, có 10 con cá vàng ở bể trái và 10 con cá bảy màu ở bể phải. (b) Trạng thái cân bằng, với 5 con cá mỗi loại trong từng bể. (c) Nếu quan sát từng con cá đơn lẻ (ở đây là một con cá bảy màu giữa đàn cá vàng), ta sẽ thấy rằng nó dành nửa thời gian bơi của mình trong mỗi bể. Cân bằng của bể trong (b) là loại trạng thái động, trung bình, chứ không phải là một điều kiện tĩnh. Cá không ngừng bơi khi chúng đã trộn đều giữa hai bể.
Tại điểm cân bằng (Hình 4-1b), tính trung bình sẽ có 5 con bảy màu và 5 con vàng trong từng bể. Nhưng sẽ không phải lúc nào cũng có 5 con cá cùng loại. Nếu 1 con bảy màu lang thang từ bể trái sang bể phải, thì nó hoặc một con bảy màu khác sẽ lang thang trở lại không lâu sau đó. Như vậy tại điểm cân bằng ta sẽ thấy rằng cá không ngừng bơi, mà chỉ qua một khoảng thời gian, tổng số các con bảy màu và cá vàng ở mỗi bể vẫn không đổi. Nếu ta có đổ vào mỗi bể 9 con cá vàng rồi thả tiếp một con bảy màu, thì ta sẽ thấy rằng, trong khi bơi tung tăng, con cá bảy màu này dành nửa thời gian trong bể này và nửa thời gian ở bể kia (Hình 4-1c).
Trong phản ứng NO đã xét, sẽ có một nồng độ phân tử NO không đổi tại điểm cân bằng, song không phải luôn có cùng sso lượng phân tử NO. Những phân tử NO sẽ phản ứng với nhau để hình thành lại N2 và O2, và phân tử những chất tham gia phản ứng lại sẽ tạo thành nhiều NO hơn. Cũng như với các con cá vàng, chỉ là đếm trên đầu cá hoặc tính mật độ thì mới nó rằng thay đổi dừng lại ở điểm cân bằng.
Điều kiện cân bằng cho phản ứng tạo thành NO, phương trình 4-1, có thể được viết lại duwois dạng hữu dụng hơn:
(4-6)
trong đó tỉ số giữa các hằng số tốc độ thuận và nghịch được biểu diễn bởi một hằng số đơn giản, hằng số cân bằng, Keq. (Trong nhiều tài liệu tiếng Việt có ghi là Kcb). Hằng số cân bằng này sẽ thay đổi khi nhiệt độ thay đổi, nhưng lại độc lập với các nồng độ của các chất tham gia và sản phẩm phản ứng. Nó cho ta biết tỉ số giữa các sản phẩm so với chất tham gia tại điểm cân bằng, và là một đại lượng cực kì hữu dụng để quyết định xem liệu một phản ứng mong muốn có xảy ra tự phát hay không.
4-3 Dạng tổng quát của hằng số cân bằng
Ta đã rút ra biểu thức hằng số cân bằng cho phản ứng NO bằng cách giả sử rằng ta đã biết cách mà những quá trình thuận và nghịch diễn ra ở cấp độ phân tử. Nếu phản ứng NO được hình thành do sự va chạm của hai phân tử, thì cách xây dựng biểu thức như trên là hoàn toàn chính xác. Cơ chế thực sự của phản ứng này lại phưc tạp hơn. Song điều quan trọng, và cũng may cho các nhà hóa học là ta không cần phải biết cơ chế phản ứng để viết được đúng hằng số cân bằng. Biểu thức hằng số cân bằng luôn có thể viết được từ phương trình đã cân bằng, mà không cần thêm thông tin nào khác, ngay cả khi các biểu thức tốc độ thuận và nghịch còn phức tạp hơn so với thấy được từ phương trình đã cân bằng. (Ta sẽ chứng tỏ điều này trong Chương 16.) Ở ví dụ với NO mà ta đang xét, phản ứng thuận thật ra diễn biến với một loạt các bước trong một dây chuyền phản ứng phức tạp. Còn phản ứng nghịch thì diễn ra bằng những phản ứng bù lại với dãy phản ứng trên; bởi vậy toàn bộ các yếu tố phức tạp đó triệt tiêu lẫn nhau trong tỉ số nồng độ cuối cùng mà cho ta hằng số cân bàng. Các chi tiết của những cơ chế này đều “vô hình” trong biểu thức hàng số cân bằng, và không liên quan gì đến việc tính toán cân bằng.
Một phản ứng hóa học tổng quát có thể được viết như sau
aA + bB  cC + dD (4-7)
cC + dD (4-7)
Trong biểu thức này, A và B biểu diễn cho các chất tham gia; C và D, các sản phẩm. Những chữ cái a, b, c, và d biểu diễn cho số các mol từng chất tham gia vào phản ứng đã cân bằng, còn dấu mũi tên đôi để chỉ định trạng thái cân bàng. Dù chỉ có hai chất tham gia và hai sản phẩm có trong phản ứng tổng quát, nhưng nguyên lý này có thể mở rộng được với số chất bất kì. Biểu thức hằng số cân bằng viết đúng cho phản ứng này là:
(4-8)
Nó bằng tỉ số giữa tích các nồng độ sản phẩm chia tích các nồng độ chất tham gia, trong đó từng giá trị nồng độ được nâng lên một lũy thừa bằng với số mol chất đó xuất hiện trong phương trình hóa học đã cân bằng. Bởi vì biểu thức được dựa trên các lượng chất tham gia lẫn sản phẩm tồn tại ở trạng thái cân bằng, nên phương trình 4-8 được gọi là định luật tác dụng khối lượng.
Ví dụ 1
Viết biểu thức hằng số cân bằng cho phản ứng sau
CO + H2O ![]() CO2 + H2
CO2 + H2
Lời giải. Hằng số cân bằng được cho bởi
Vì cả 4 chất đều có hệ số bằng 1 trong phương trình đã cân bằng, nên các nồng độ của chúng đều được nâng lên số mũ bậc nhất trong biểu thức hằng số cân bằng.
Ví dụ 2
Biểu thức hằng số cân bằng cho sự thành tạo nước từ các khí hydro và oxi như thế nào? Phản ứng là
2H2 + O2 ![]() 2H2O
2H2O
Lời giải.
Vì có 2 mol hydro và 2 mol nước có mặt trong phương trình hóa học này, nên các nồng độ của chúng được bình phương trong biểu thức tính Keq.
Ví dụ 3
Viết biểu thức hằng số cân bằng cho sự phá vỡ liên kết nước thành hydro và oxy. Phản ứng là
2H2O![]() 2H2 + O2
2H2 + O2
Lời giải.
Ở đây có một điểm chung quan trọng. Phản ứng này là dạng nghịch của phản ứng trong Ví dụ 2, và biểu thức hằng số cân bằng cũng là nghịch đảo của hằng số trước đây. Nếu một phản ứng hóa học đã cân bằng được đảo ngược lại, thì biểu thức hằng số cân bằng phải được nghịch đảo, bởi lẽ những chất trước đây từng là chất tham gia thì bây giờ đã là sản phẩm, và ngược lại.
Ví dụ 4
Phản ứng phá vỡ liên kết nước viết như sau vẫn đúng
H2O![]() H2 + ½O2
H2 + ½O2
Khi đó biểu thức hằng số cân bằng sẽ là bao nhiêu?
Lời giải.
Lưu ý ràng khi phản ứng ở Ví dụ 3 được chia đôi, kết quả là phản ứng ở Ví dụ 4, thì hằng số cân bằng sẽ là căn bậc hai của giá trị cũ, hay là giá trị Keq cũ lũy thừa 1/2. Tương tự, nếu phản ứng được nhân đôi, thì giá trị Keq này sẽ phải được bình phương. Nói chung, hoàn toàn đúng đắn nếu ta nhân tất cả những hệ số của một phản ứng đã cân bằng với một số n âm hoặc dương bất kì, và phương trình vẫn đảm bảo cân bằng. (Việc nhân tất cả các hệ số phương trình với –1, về hình thức, thì cũng giống như là viết phương trình theo chiều ngược lại. Hãy viết một phương trình đơn giản và tự bạn chứng minh lấy điều này.) Nhưng nếu nhân tất cả các hệ số của một phương trình với n, thì biểu thức hằng số cân bằng mới sẽ bằng giá trị cũ nâng lên lũy thừa thứ n. Bởi vậy, khi tính với các hằng số cân bằng, ta phải nhớ kĩ các phản ứng hóa học đi kèm theo.
Ví dụ 5
Phản ứng thành tạo hoặc phá vỡ ammonia có thể được viết theo nhiều cách khác nhau:
a) N2 + 3H2 ![]() 2NH3
2NH3
b) ½N2 + 3/2H2 ![]() NH3
NH3
c) 1/3N2 + H2 ![]() 2/3NH3
2/3NH3
d) 2NH3 ![]() ½N2 + 3/2H2
½N2 + 3/2H2
(Mỗi biểu thức trong số trên đây có thể phù hợp tùy theo bạn đang quan tâm đến ni-tơ, ammonia, hydro, hay sự phá vỡ liên kết ammonia.) Các biểu thức hằng số cân bàng cho từng cách viết trên sẽ như thế nào, và các hằng số cân bằng này có liên hệ với nhau như thế nào?
Lời giải.
a)
b)
c)
d)
Lưu ý rằng không có gì sai đối với các số mũ là phân số trong biểu thức hằng số cân bằng.
4-4 Sử dụng các hằng số cân bằng
Các hằng số cân bằng có hai tác dụng chính:
- Để giúp ta biết liệu một phản ứng sẽ tự phát trong điều kiện cụ thể hay không.
- Cho phép ta tính nồng độ của các chất tham gia và sản phẩm phản ứng một khi cân bằng đã đạt được.
Ta có thể minh họa cách dùng các hằng số cân bằng để đạt hai mục đích trên, và cũng minh họa rằng hằng số cân bằng thực sự là không đổi, với số liệu thực đo được từ một trong những phản ứng được nghiên cứu nhiều nhất, đó là phản ứng giữa hydro và iot để tạo ra hydro iodua.
H2(k) + I2(k) ![]() 2HI (k) (4-9)
2HI (k) (4-9)
Nếu ta trộng hydro và iot vào một bình kín rồi quan sát phản ứng, thì màu tím nhạt dần của hơi iot sẽ cho ta thấy rằng iot đang bị tiêu thụ. Phản ứng này được tìm hiểu lần đầu bởi nhà hóa học người Đức, Max Bodenstein vào năm 1893. Bảng 4-1 chứa những số liệu lấy từ thí nghiệm của Bodenstein. Dữ liệu thực nghiệm được ghi trong ba cột đầu tiên. Ở cột thứ tư, ta đã tính một tỉ số đơn giản giữa nồng độ sản phẩm và các chất tham gia, [HI]/[H2][I2], để xem liệu đại lượng này có phải hằng số hay không. Chắc chắn là không phải, bởi khi nồng độ hydro giảm và nồng độ iot tăng, thì tỉ số nêu trên thay đổi từ 2,60 xuống thấp dưới 1. Định luật tác dụng khối lượng (Mục 4-3) phát biểu rằng biểu thức hằng số cân bằng sẽ phải chứa bình phương của nồng độ HI, bởi phản ứng này cho thấy có 2 mol HI ứng với mỗi mol H2 và I2. Cột thứ 5 cho thấy rằng tỉ số [HI]/[H2][I2] gần như không đổi trong một độ lệch bình quân khoảng chừng 3%. [Đây là các số liệu gốc của Bodenstein. Những số liệu hiện đại có thể chính xác hơn nhiều, với độ lệch Keq ít hơn. Độ lệch bình quân là trung bình cộng các độ lệch từng kết quả Keq tính được so với giá trị Keq trung bình.] Do đó, tỉ số này là biểu thức hợp lý cho hằng số cân bàng, và giá trị trung bình của Keq trong 6 lần thực hiện này là 50,53.
Bảng 4-1 Kết quả đo nồng độ cân bằng từ thí nghiệm*
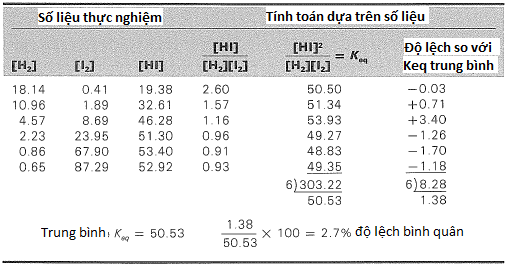
*Đối với phản ứng H2(k) + I2(k) ![]() 2HI (k), ở 448ºC trong một bể hơi lưu huỳnh giữ nhiệt độ không đổi. Các nồng độ được đo bằng mol trên lit × 10³ (nghĩa là số liệu nồng độ hydro đầu tiên là 18,14 ×10−3 mol/lit).
2HI (k), ở 448ºC trong một bể hơi lưu huỳnh giữ nhiệt độ không đổi. Các nồng độ được đo bằng mol trên lit × 10³ (nghĩa là số liệu nồng độ hydro đầu tiên là 18,14 ×10−3 mol/lit).
Hằng số cân bằng có thể được dùng để xác định xem liệu một phản ứng trong các điều kiện cụ thể sẽ xảy ra tự phát theo hướng thuận hay nghịch. Tỉ số giữa nồng độ sản phẩm chia nồng độ chất tham gia, cũng giống hệ số cân bằng về mặt hình thức, song không nhất thiết ở điều kiện cân bằng, thì được gọi là hệ số phản ứng, Q:
(không nhất thiết tại điểm cân bằng) (4-10)
Nếu có quá nhiều phân tử chất tham gia khiến cho không tồn tại trạng thái cân bằng, thì các giá trị nồng độ ở mẫu số sẽ làm cho hệ số phản ứng, Q, nhỏ hơn Keq. Phản ứng sẽ diễn biến theo chiều thuận để tạo thành sản phẩm. Tuy nhiên, nếu một thí nghiệm được bố trí sao cho hệ số phản ứng lớn hơn Keq, thì có nhiều phân tử sản phẩm có mặt khiến cho không tồn tại cân bằng, và phản ứng nghịch sẽ diễn biến tự phát. Do vậy, một phép so sánh giữa tỉ lệ nồng độ thực tế, hay hệ số phản ứng, với hằng số cân bằng sẽ cho phép ta dự đoán được phản ứng sẽ xảy ra tự phát theo chiều nào, dưới điều kiện cho trước:
Q < Keq (phản ứng thuận tự phát)
Q > Keq (phản ứng nghịch tự phát) (4-11)
Q = Keq (các chất tham gia và sản phẩm ở điểm cân bằng)
Ví dụ 6
Nếu 1,0 × 10−2 mol của từng khí hydro và iot được đặt vào một bình 1 lít ở 448ºC với 2,0 × 10−3 mol HI, thì liệu sẽ có thêm HI được tạo thành không?
Lời giải. Hệ số phản ứng trong điều kiện này là
Giá trị này nhỏ hơn giá trị cân bằng là 50,53 trong Bảng 4-1; điều đó cho ta thấy rằng có mặt quá nhiều chất tham gia phản ứng. Bởi vậy, cân bằng sẽ chưa thể đạt tới, trước khi có thêm HI được tạo ra.
Ví dụ 7
Nếu chỉ có 1,0 × 10−3 mol của từng chất H2 và I2 được dùng đến, cùng với 2,0 × 10−3 mol HI, thì liệu sẽ có thêm HI được tạo ra theo cách tự phát không?
Lời giải. Bạn có thể kiểm tra để khẳng định rằng hệ số phản ứng là Q = 4,0. Giá trị này nhỏ hơn Keq, nên phản ứng thuận vẫn còn tự phát.
Ví dụ 8
Nếu các điều kiện trong Ví dụ 7 được thay đổi sao cho nồng độ HI được tăng lên thành 2,0 × 10−2 mol/lit, thì điều gì sẽ xảy đến với phản ứng?
Lời giải. Bây giờ hệ số phản ứng là Q = 400. Giá trị này lớn hơn Keq. Bây giờ có quá nhiều phân tử sản phẩm và quá ít phân tử chất tham gia khiến cân bằng không tồn tại được. Do vậy phản ứng nghịch diễn ra nhanh hơn phản ứng thuận. Cân bằng chỉ đạt đến bằng cách biến đổi một phần HI thành H2 và I2, như vậy phản ứng nghịch là tự phát.
Ví dụ 9
Nếu các điều kiện trong Ví dụ 7 được thay đổi sao cho nồng độ HI là 7,1 × 10−3 mol/lit, thì phản ứng sẽ tự phát theo chiều nào?
Lời giải. Dưới điều kiện này,
Vì Q bằng Keq trong khuôn khổ độ chính xác dữ liệu đã thu thập, nên hệ thống nêu trên ở trạng thái cân bằng, và cả phản ứng thuận lẫn nghịch đều không phải là tự phát. (Hai phản ứng này dĩ nhiên vẫn xảy ra ở cấp độ phân tử, nhưng chúng cân bằng nhau nên hiệu ứng tổng cộng sẽ triệt tiêu.)
Công dụng thứ hai của hằng số cân bằng là để tính các nồng độ của các chất tham gia và sản phẩm phản ứng có mặt ở điểm cân bằng.
Ví dụ 10
Nếu một bình một lít có chứa 1,0 × 10−3 mol của từng khí H2 và I2 ở 448ºC thì lượng HI có mặt sẽ là bao nhiêu khi hỗn hợp khí ở điểm cân bằng?
Lời giải. Biểu thức Keq được coi như một phương trình đại số thông thường, và để giải ra nồng độ HI:
[HI]² = 50,53 × 1,0 × 10−6.
[HI] = 7,1 × 10−3 mol/lit
Bạn có thể kiểm tra lại để khẳng định rằng nồng độ HI ở Ví dụ 7 còn nhỏ hơn giá trị cân bằng này; ở Ví dụ 8 thì lớn hơn; còn ở Ví dụ 9 thì đúng bằng giá trị này.
Ví dụ 11
Một phần mười của mol, 0,1 mol, hydro iodua được đặt vào bình thủy tinh trống có dung tích 5,0 lít ở 448ºC. Khi các chất bên trong đã đạt tới trạng thái cân bằng thì sẽ có bao nhiêu hydro và iot ở trong bình?
Lời giải. Từ các hệ số cân bằng cho phản ứng thì các nồng độ H2 và I2 phải như nhau. Với mỗi mol H2 và I2 được tạo thành, phải có 2 mol HI bị phân hủy. Đặt y là số mol H2 hoặc I2 trong mỗi lít có mặt ở điểm cân bằng. Nồng độ ban đầu của HI trước khi hiện tượng phá vỡ liên kết xảy ra là
[HI]o =
= 0,020 mol/lit
Trước hết, hãy viết một phương trình cân bằng cho phản ứng này, rồi lập một bảng ghi các nồng độ ở điểm ban đầu và điểm cân bằng:
. H2 + I2 2HI Ban đầu (mol/l): 0 . 0 . 0,020 Cân bằng: y . y . 0,020 – 2y Nồng độ HI bằng 0,020 mol/l đã giảm đi mất 2y ứng với mỗi y mol của H2 và I2 được tạo nên. Biểu thức hằng số cân bằng là:
50,53 =
Ngay lập tức ta thấy rằng có thể làm tắt bằng cách lấy căn bậc hai của hai vế:
7,11 =
9,11 y = 0,020
y = 0,0022 mol/l
Với 5 lít, 5 × 0,0022 = 0,011 mol H2 và từng ấy mol I2 sẽ có mặt tại điểm cân bằng. Chỉ còn lại (0,020 – 0,0044) × 5 = 0,080 mol HI trong bình 5 lít này, và phần HI đã phân tách tại điểm cân bằng là:
= 0,22 ; hay 22% phân tách
Các phép tính tắt kiểu như lấy căn bậc hai trong ví dụ trên thì không phải lúc nào cũng làm được, song một phần của kĩ năng giải bài toán cân bằng lại ở chỗ phát hiện được những lối tắt khi chúng xuất hiện và biết cách tận dụng chúng. Điểm mấu chốt thường là một trực giác tốt để thấy được đại lượng nào là lớn và nhỏ khi so sánh tương đối với nhau; trực giác này bắt nguồn từ sự luyện tập tư duy và hiểu được bản chất hóa học. Bạn nên nhớ rằng đây là những bài hóa học, chứ không phải toán học.
Trong nhiều trường hợp, ta phải giải một phương trình bậc hai.
Ví dụ 12
Nếu 0,00500 mol khí hydro và 0,0100 mol khí iot được đặt vào bình 5,00 lít ở 448ºC, thì sẽ có bao nhiêu HI có ở điểm cân bằng?
Lời giải. Các nồng độ ban đầu của H2 và I2 là
= 0,00100 mol/lit
= 0,00200 mol/lit
Lần này, đặt ẩn số y là số mol mỗi lít của H2 hoặc I2 đã phản ứng tại điểm cân bằng:
. H2 + I2 2HI Ban đầu (mol/l): 0,00100 . 0,00200 . 0,0 Cân bằng: 0,00100-y . 0,00200-y . 2y Biểu thức cân bằng là:
50,53 =
Bây giờ thì cách làm tắt lấy căn bậc hai không còn phát hy tác dụng bởi các nồng độ khởi điểm của H2 và I2 thì không bằng nhau. Thay vì làm tắt, ta phải rút gọn phương trình trên thành một tam thức bậc hai:
46,53y² – 0,1516y + 1,011 × 10−4 = 0
Một phương trình bậc hai tổng quát dạng ay² + by + c = 0 có thể giải được bằng công thức bậc hai,
Bởi vậy với bài này,
y = 2,32 × 10−3 và 0,935 × 10−3 mol/l.
Nghiệm thứ nhất là vô lý vì nó cho thấy rằng lượng H2 phản ứng còn nhiều hơn cả lượng đã có ban đầu. Nghiệm thứ hai là đáp số đúng, y = 0,935 × 10−3 mol/l. Do vậy, các nồng độ cân bằng là:
[H2] = 0,00100 – 0,000935 = 0,065 × 10−3 mol/l.
[I2] = 0,00200 – 0,000935 = 1,065 × 10−3 mol/l.
[HI] = 2(0,935 × 10−3) = 1,87 × 10−3 mol/l.
4-5 Các đơn vị và hằng số cân bằng
Như ta đã thấy, cặp ngoặc vuông bao quanh một kí hiệu hóa học, như [N2], dùng để biểu diễn nồng độ, thường nhưng không nhất thiết lấy đơn vị là mol lit−1. Các nồng độ biểu diễn là mol lit−1 thường được gắn cho một kí hiệu riêng, c, như cN2, nồng độ của N2 tính theo mol lit−1. Hằng số cân bằng với các nồng độ đo bằng những đơn vị này được kí hiệu là Kc.
Một hằng số cân bằng như ta đã định nghĩa co đến giờ, bản thân nó có thể mang đơn vị. Ở Ví dụ 1, Keq là phi thứ nguyên vì các đơn vị mol²lit−1 ở cả tử số và mẫu số triệt tiêu lẫn nhau. Ở Ví dụ 2, các đơn vị của Kc là mol−1 lit, vì nồng độ xuất hiện với số mũ 2 ở tử số và số mũ 3 ở mẫu số. Trong Ví dụ 3, các đơn vị của Kc thì ngược lại: mol lit−1. Các đơn vị cần đến ở Ví dụ 4, mol1/2 lit −1/2, trông có thể lạ nhưng chứng hoàn toàn có ý nghĩa.
Ví dụ 13
Các đơn vị của những hằng số cân bằng trong bốn phản ứng ở Ví dụ 5 là gì?
Lời giải.
Hằng số Đơn vị Ka mol−2 lit2 Kb mol−1 lit Kc mol−2/3 lit2/3 Kd mol lit−1
Câu hỏi đặt ra về đơn vị của Keq sẽ trở nên quan trọng một khi ta nhận thấy rằng có thể đo nồng độ bằng những đơn vị khác ngoài mol lit−1. Áp suất riêng phần tính theo atmotphe là một đơn vị thuận tiện khi ta tính với các hỗn hợp khí, và hằng số cân bằng lúc đó được kí hiệu bởi Kp. Vì các giá trị của Kp và Kc nói chung sẽ khác nhau, ta phải nắm vững là đang lấy đơn vị nào khi dùng đến một hằng số.
Ví dụ 14
Một bước trong khâu điều chế axit sunfuric công nghiệp là phản ứng giữa lưu huỳnh dioxit với oxy để tạo nên lưu huỳnh trioxit:
SO2 + O2
2SO3
Ở 1000 K, hằng số cân bằng cho phản ứng này là Kp = 3,50 atm−1. Nếu áp suất tổng trong lò phản ứng là 1,00 atm và áp suất riêng phần của lượng O2 không dùng đến ở điểm cân bằng là 0,10 atm, thì tỉ số giữa nồng độ sản phẩm (SO3) so với chất tham gia (SO2) sẽ bằng bao nhiêu?
Lời giải.
( pj = áp suất riêng phần của j )
Tỉ số =
= 0,5
Hỗn hợp ở cân bằng có 0,59 mol SO3 ứng với mỗi mol SO2.
Định luật khí lí tưởng cho phép ta chuyển đổi giữa atmotphe và mol lit−1, và cũng giữa Kp và Kc:
PV = nRT (3-8)
P = (n/V) RT = cRT (4-12)
Trong phản ứng hóa học tổng quát đã viết ở trên,
aA + bB ![]() cC + dD (4-7)
cC + dD (4-7)
Δn (đọc là “đen-ta n”), độ tăng số mol khí trong quá trình phản ứng, thì bằng
Δn = c + d – a – b (4-13)
Biểu thức hằng số cân bằng viết dưới dạng những áp suất riêng phần là
(4-14)
Với định luật khí lí tưởng được áp dụng cho từng thành phần khí, ta có thể chuyển đổi biểu thức này sang Kc:
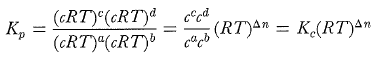 (4-15)
(4-15)
(Đừng nhầm lẫn giữa hai công dụng của hai kí hiệu chữ c trong phương trình 4-15: một là dùng cho nồng độ tính theo mol lit−1 và cái kia là số mol của chất C.)
Ví dụ 15
Trị số của Kc trong phản ứng ở Ví dụ 14 là bao nhiêu?
Lời giải. Ba mol khí của các chất tham gia được chuyển đổi chỉ thành 2 mol sản phẩm, vậy Δn = –1. Vậy ở 1000 K,
Kp = 3,50 atm−1 = Kc (RT)−1
Kc = Kp × RT
= 3,50 atm−1 × 0,08205 lit atm K−1 mol−1 × 1000 K
= 287 mol−1 lit
Dù cho đáp số thu được khi dùng những đơn vị khác nhau có thể sẽ khác biệt, song ý nghĩa vật lý phải như nhau.
Ví dụ 16
Nồng độ của oxy trong Ví dụ 14 tính theo mol lit−1 bằng bao nhiêu? Giải lại Ví dụ 14 lấy giá trị Kc theo Ví dụ 15.
Lời giải.
= 287 mol−1 lit
= 0,00122 mol lit−1
Tỉ số =
= 0,59
Khi dùng với atmotphe, ta vẫn tính được cùng tỉ số SO3 chia SO2. Như vậy cách chọn lựa là tùy theo bạn.
4-6 Cân bằng trong trường hợp có chất khí với chất lỏng hoặc rắn
Tất cả những ví dụ đã xét trên đây đều chỉ có một trạng thái vật lý, là một chất khí, và đồng thời là những ví dụ về cân bằng đồng nhất. Những cân bằng có từ hai trạng thái vật lý trở lên (như khí với chất lỏng hoặc chất rắn) thì được gọi là cân bằng dị thể. Nếu có một hoặc nhiều chất tham gia hoặc sản phẩm phản ứng là chất rắn hoặc lỏng, thì điều này sẽ ảnh hưởng thế nào đến dạng thức của hằng số cân bằng?
Câu trả lời ngắn gọn là, bất khì chất rắn hoặc lỏng tinh khiết nào có mặt tại điểm cân bằng thì đều có cùng hiệu ứng đối với trạng thái cân bằng, bất kể là có bao nhiêu chất rắn hoặc chất lỏng. Nồng độ của một chất rắn hoặc lỏng tinh khiết có thể được coi là không đổi, và để cho tiện lợi, thì tất cả những đại lượng không đổi này đều được đưa qua vế trái của phương trình và được kèm vào bản thân hằng số cân bằng. Lấy ví dụ, đá vôi (canxi cacbonat, CaCO3) phân tách thành vôi sống (canxi oxit, CaO) và cacbon đi oxit, CO2:
CaCO3(r) ![]() CaO (r) + CO2 (k)
CaO (r) + CO2 (k)
Biểu thức hằng số cân bằng đơn giản là:
Miễn là còn có đá vôi và vôi sống thể rắn tiếp xúc với khí, thì hiệu ứng do chúng đối với cân bằng là không thay đổi. Do đó các đại lượng [CaCO3] và [CaO] vẫn giữ nguyên không đổi và có thể được gộp vào cùng K‘eq:
Dạng thức này của biểu thức hằng số cân bằng cho ta biết rằng, ở một thiệt độ xác định, nồng độ của khí cacbon đi-oxit phía trên đá vôi và canxi oxit là một đại lượng cố định. (Điều này chỉ đúng khi có mặt đồng thời cả hai thể rắn.) Đo nồng độ bằng đơn vị atmotphe, ta có
Kp = pCO2
với giá trị thực nghiệm 0,236 atm ở 800ºC.

Hình 4-2 CaCO3 rắn và CaO được đặt vào một bình hình trụ với pit-tông di chuyển được, vốn ban đầu được ấn chặt vào khối chất rắn để đẩm bảo rằng không có khí bên ngoài có mặt. Ở điểm cân bằng, có đủ lượng CaCO3 phân tách để cho áp suất khí CO2 phía trên khối chất rắn là một giá trị cố định, chỉ thay đổi theo nhiệt độ nhưng không lệ thuộc vào lượng từng chất rắn có mặt là bao nhiêu.
Ta có thể thấy được ý nghĩa điều này qua thực nghiệm bằng cách xét một bình hình trụ được bỏ vào CaCO3 và CaO. Bình này có một pit-tông dịch chuyển được, như trên Hình 4-2. Nếu pit-tông được cố dịnh ở một vị trí, thì CaCO3 sẽ phân tách cho đến khi áp suất của CO2 phía trên khối rắn là 0,23 atm (nếu nhiệt độ là 800ºC). Nếu bạn thử giảm áp suất này bằng cách kéo pit-tông lên, thì sẽ có thêm CaCO3 phân tách cho đến khi áp suất lại tăng lên thành 0,23 atm. Ngược lại, nếu bạn thử tăng áp suất bằng cách ấn pit-tông xuống, thì một phần khí CO2 sẽ phản ứng với CaO và biến thành CaCO3, làm giảm lượng khí CO2 có mặt xuống đến khi áp suất một lần nữa lại là 0,23 atm. Cách duy nhất để làm tăng pCO2 là tăng nhiệt độ, vốn sẽ làm tăng giá trị của bản thân Kp lên tới 1 atm ở 894ºC và tới 1,04 atm ở 900ºC.
Một ví dụ thậm chí còn đơn giản hơn, đó là sự hóa hơi một chất lỏng như nước:
H2O(l) ![]() H2O(k)
H2O(k)
Quá trình này có thể được coi là một phản ứng hóa học về mặt hình thức, mặc dù các liên kết bên trong phân tử không hề được lập nên hay phá vỡ. Hãy tưởng tượng rằng bình đựng trên Hình 4-2 được đổ nước lên tới lưng chừng, thay vì CaCO3 và CaO, và ban đầu pit-tông được đặt ở mặt nước. Khi pit-tông được nâng lên, chất lỏng sẽ bay hơi đến khi áp suất của hơi nước là một giá trị hằng số chỉ phụ thuộc vào nhiệt độ. Đây chính là áp suất hơi cân bằng của nước tại nhiệt độ đó. Ở 25ºC, áp suất hơi của nước bằng 0,0313 atm. Ở 100ºC, áp suất hơi này tăng thành 1 atm, và như ta sẽ thấy ở Chương 18, đây chỉ là cách định nghĩa điểm sôi bình thường của nước. Áp suất của hơi nước bên trên mặt chất lỏng đựng trong bình không phụ thuộc vào độ cao cột nước trong bình có là 1 cm hay 10 cm; yêu cầu duy nhất chỉ là có nước trong đó và nước có khả năng bay hơi để gây ra giảm áp suất hơi. Chỉ khi pit-tông được nâng lên tới điểm mà không còn chất lỏng nữa thì áp suất của hơi nước mới giảm xuống dưới mức 0,0313 atm, nếu bình được đặt ở 25ºC. Tương tự, nếu pit-tông được ấn xuống, một số hơi nước sẽ ngưng tụ, giữ áp suất ở 0,0313 atm. Chỉ khi tất cả hơi đều ngưng tụ hết và pit-tông đã chạm mặt chất lỏng thì áp suất trong bình mới tăng lên vượt ngưỡng 0,0313 atm.
Biểu thức chặt chẽ viết cho sự bốc hơi nước là:
[H2O(l)] = hằng số, miễn là còn nước lỏng
Tính theo đơn vị áp suất, biểu thức trên sẽ trở thành
Kp = pH2O(k)
Từ quan điểm thực dụng, những nhận xét trên có ý nghĩa rằng các đại lượng nồng độ cho những chất rắn và chất lỏng tinh khiết đều có thể lược bỏ một cách đơn giản khỏi biểu thức hàng số cân bằng. (Chúng được biểu thị ngầm trong Keq.)
Ví dụ 17
Nếu như phản ứng với hydro iodua như đã thảo luận ở phần trước chương này được tiến hành trong nhiệt độ phòng, thì iot sẽ tồn tại dưới dạng tinh thể tím thẫm thay vì dưới dạng hơi. Khi đó, biểu thức hằng số cân bằng sẽ có dạng nào, và liệu cân bằng này có phụ thuộc vào lượng tinh thể iot có mặt không?
Lời giải. Phản ứng là
H2(k) + I2(r)
2HI(k)
và biểu thức hằng số cân bằng là:
Miễn là còn chút nào tinh thể I2(r) tồn tại, thì lượng này không quan trọng đối với cân bằng.
Ví dụ 18
Thiếc(IV) oxit phản ứng với cacbon monoxit để tạo ra thiếc kim loại và CO2, theo phản ứng
SnO2(r) + 2CO(k)
Sn(r) + 2CO2(k)
Biểu thức hằng số cân bằng sẽ như thế nào?
Lời giải.
Ví dụ 19
Với phản ứng sau tạo nên nước lỏng, biểu thức hằng số cân bằng sẽ như thế nào?
CO2(k) + H2(k)
CO(k) + H2O(l)
Biểu thức nêu trên sẽ như thế nào nếu sản phẩm là hơi nước?
Lời giải. Nếu sản phẩm là H2O(l), biểu thức hằng số cân bằng là
Nếu sản phẩm là H2O(k), biểu thức hằng số cân bằng là
Ví dụ trên cho thấy rằng miễn là có nước lỏng thì nồng độ pha khí (hơi) sẽ được cố định bằng áp suất hơi của nước ở nhiệt độ đó. Do vậy, sự đóng góp của nước, vốn là hằng số, đã được gộp vào Keq.
4-7 Các nhân tố ảnh hưởng đến cân bằng: Nguyên lý Le Chatelier
Trạng thái cân bằng biểu hiện một sự thăng bằng giữa hai phản ứng ngược chiều nhau. Vậy thăng bằng nhạy đến đâu dưới tác dụng những thay đổi trong điều kiện xảy ra phản ứng? Ta có thể làm gì để thay đổi trạng thái cân bàng? Đây là những câu hỏi rất thực tế nếu như giả dụ có ai đó cố gắng tăng lượng chất sản phẩm hữu ích trong một phản ứng hóa học.
Dưới những điều kiện cụ thể, biểu thức hằng số cân bằng cho ta biết tỉ số giữa sản phẩm chia các chất tham gia phản ứng khi những phản ứng thuận và nghịch đang thăng bằng với nhau. Hằng số cân bằng này không bị ảnh hưởng bởi những thay đổi về nồng độ của các chất tham gia hay sản phẩm. Tuy nhiên, nếu sản phẩm phản ứng có thể được lấy đi một cách liên tục, thì hệ phản ứng có thể được duy trì luôn mất thăng bằng. Sẽ có nhiều chất tham gia bị sử dụng hơn và tạo ra một dòng liên tục chất sản phẩm. Phương pháp này rất có ích khi một sản phẩm của phản ứng có thể thoát ra như một khí, được cô đặc hay đóng băng dưới thể rắn/lỏng từ thể khí, được rửa trôi khỏi hỗn hợp khí bởi một tia chất lỏng có tính hòa tan rất tốt, hay được kêt tủa từ một khí hay dung dịch.
Chẳng hạn, khi vôi sống rắn (CaO) và than cốc (C) được nung trong lò điện để tạo thành canxi cacbua (CaC2),
CaO(r) + 3C(r) ![]() CaC2(r) + CO(k)↑
CaC2(r) + CO(k)↑
thì phản ứng này, vốn có hằng số cân bằng gần với 1,00 trong điều kiện nhiệt độ 2000-3000ºC, sẽ nghiên về hướng tạo thành canxi cacbua qua việc liên tục lấy đi khí cacbon monoxit. Trong quy trình công nghiệp sản xuất titan dioxit cho thuốc màu (pigment), TiCl4 và O2 phản ứng dưới thể khí:
TiCl4(k) + O2(k) ![]() TiO2(r)↓ + 2Cl2(k)
TiO2(r)↓ + 2Cl2(k)
Sản phẩm đã tách khỏi các khí tham gia, dưới dạng bột mịn TiO2 rắn, và phản ứng này do đó tiếp tục diễn ra theo chiều thuận. Khi etyl axetat hoặc những este khác, vốn dùng làm dung môi và chất tạo hương vị, được tổng hợp từ những axit cacboxylic và những chất rượu,
CH3COOH + HOCH2CH3 ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
axit axetic ….. etanol …….. etyl axetat
phản ứng này được giữ liên tục mất cân bằng thông qua việc tháo nước ngay khi nó được tạo ra. Cách này có thể thực hiện nhờ một tác nhân làm khô như Drierite (CaSO4), bằng cách tiến hành phản ứng trong benzen và đun sôi liên tục một hỗn hợp benzen-nước để tách, hay bằng cách tiến hành phản ứng trong một dung môi mà nước không hòa tan được và hình thành những giọt nhỏ như một pha riêng biệt. Một ví dụ cuối cùng: Vì ammoniac tan tốt trong nước, hơn nhiều so với cả nitơ lẫn hydro, nên hiệu suất tạo thành ammonia có thể tăng lên vượt hẳn 90% bằng cách lấy dòng nước để rửa ammoniac khỏi hỗn hợp cân bằng các khí, rồi tái sử dụng lượng nitơ và hydro.
Nhiệt độ
Tất cả những phương thức nêu trên sẽ làm lật đổ cân bằng (với ví dụ đã xét, thì đều hướng về những sản phẩm mong muốn) mà không làm thay đổi hằng số cân bàng. Một nhà hóa học thường có thể nâng cao hiệu suất các sản phẩm mong muốn bằng cách tăng giá trị hằng số cân bằng để cho tỉ số của các sản phẩm chia các chất tham gia, ở điểm cân bằng, là lớn hơn. Hằng số cân bằng thường phụ thuộc vào nhiệt độ. Nhìn chung, cả phản ứng thuận và nghịch đều được tăng tốc nhờ tăng nhiệt độ, vì những phân tử trong đó chuyển độ nhanh hơn và va chạm thường xuyên hơn. Nếu độ tăng tốc của phản ứng thuận lớn hơn của phản ứng nghịch thì Keq tăng theo nhiệt độ và sẽ có nhiều sản phẩm được tạo ra ở điểm cân bằng. Nếu phản ứng nghịch được ưa chuộng, thì Keq sẽ giảm. Như vậy Keq của phản ứng hydro-iot ở 448ºC là 50,53, nhưng ở 425ºC là 54,4, và ở 357ºC hằng số này lên đến 66,9. Việc sản xuất ra HI phần nào được ưa chuộng qua việc tăng nhiệt độ, nhưng sự phân tách của nó thành hydro và iot còn được ưa chuộng hơn nhiều.
Phản ứng thành tạo hydro iotua là phản ứng tỏa nhiệt:
H2(k) + I2(k) ![]() 2HI(k)
2HI(k)
ΔH298 = –10,2 kJ cho mỗi 2 mol HI
(Nếu bạn kiểm tra con số này so với Phụ lục 3, thì hãy hớn rằng phản ứng này có hơi iot tham gia, chứ không phải iot rắn.) Nếu nhiệt độ bên ngoài của phán ứng này được hạ thấp, thì cân bằng được chuyển dịch thiên về phản ứng tỏa nhiệt hay phản ứng thuận. Ngược lại, nếu nhiệt độ được tăng lên, thì phản ứng nghịch, để tạo ra H2 và I2, lại được ưa hơn. Cân bằng chuyển dịch sao cho nó phần nào chống lại ảnh hưởng của việc tăng nhiệt bên ngoài hay giảm nhiệt (qua việc nâng/hạ nhiệt độ).
Sự phụ thuộc của điểm cân bằng vào nhiệt độ là một ví dụ minh họa một nguyên lý tổng quát hơn, đó là nguyên lý Le Chatelier: Nếu một tác động bên ngoài được đặt vào hệ thống tại điểm cân bằng hóa học, thì điểm cân bằng sẽ thay đổi theo cách chống lại ảnh hưởng của tác động đó. Nếu nửa thuận của một phản ứng cân bằng có tính tỏa nhiệt, thì Keq sẽ giảm khi nhiệt độ tăng; còn nếu nó có tính thu nhiệt thì Keq sẽ giảm. Chỉa với một phản ứng thu nhiệt thì hiệu suất tạo thành sản phẩm mới được nâng cao bằng cách tăng nhiệt độ. Một cách dễ nhớ điều này là viết rõ phản ứng với một số hạng nhiệt lượng:
H2(k) + I2(k) ![]() 2HI(k) + nhiệt (tỏa)
2HI(k) + nhiệt (tỏa)
Khi đó ta sẽ thấy rõ rằng việc bổ sung nhiệt lượng, cũng như bổ sung HI, sẽ làm phản ứng dịch chuyển sang trái. (Xem Hình 4-3.)
Hình 4.3 Nguyên lý Le Chatelier và nhiệt độ. Sự phân tách ammoniac,
2NH3(k) → 3H2(k) + N2(k)
có tính tỏa nhiệt. (a) Cân bằng ammoniac tại nhiệt độ phòng. (b) Việc nhiệt độ tăng nhờ bổ sung nhiệt đã phần nào bị chống lại bởi việc dùng một phần nhiệt để phân tách các phân tử NH3 và hình thành N2 và H2. Từ tài liệu: Dickerson and Geis, Chemistry, Matter, and the Universe.
Áp suất
Nguyên lý Le Chatelier hoàn toàn đúng với những loại tác động khác, chẳng hạn như thay đổi áp suất. Hệ số cân bằng Keq không bị thay đổi bởi một sự thay đổi áp suất tại nhiệt độ không đổi. Tuy nhiên, các lượng tương đối của những chất tham gia và sản phẩm sẽ thay đổi theo một cách mà ta có thể dự đoán được theo nguyên lý Le Chatelier.
Phản ứng hydro-iot có số mol các chất tham gia và phản ứng bằng nhau (đều bằng 2). Do vậy, nếu ta tăng gấp đôi áp suất ở nhiệt độ không đổi, thì thể tích hỗn hợp khí này sẽ giảm đi còn một nửa. Tất cả những nồng độ tính theo mol lit−1 đều được tăng gấp đôi, nhưng tỉ số giữa chúng vẫn giữ nguyên. Trong Ví dụ 12, việc tăng gấp đôi các tỉ số giữa các chất tham gia phản ứng và sản phầm sẽ không làm thay đổi hằng số cân bằng:
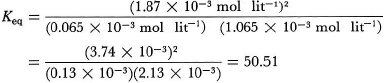
Như vậy cân bằng hydro-iot không bị nhạy trước ảnh hưởng của thay đổi áp suất. Lưu ý rằng ở đây Keq không có đơn vị, bởi vì các đơn vị nồng độ có trong tử số và mẫu số đã triệt tiêu nhau.
Trái lại, sự phân tách của ammoniac thì bị ảnh hưởng bởi sự thay đổi áp suất bởi số mol các chất tham gia (vốn là 2 mol) sẽ không bằng tổng số mol các sản phẩm (4 mol):
2NH3(k) ![]() 3H2(k) + N2(k)
3H2(k) + N2(k)
Hằng số cân bằng cho phản ứng này ở 25ºC là
Keq = = 2,5 × 10−9 mol²lit−1.
Một bộ các điều kiện cân bằng là:
N2 = 3,28 × 10−3 mol lit−1,
H2 = 2,05 × 10−3 mol lit−1,
NH3 = 0,106 mol lit−1.
(Bạn có thể kiểm tra để khẳng định rằng các giá trị nồng độ này thỏa mãn điều kiện cân bằng không?) Nếu bây giờ ta tăng gấp đôi áp suất ở nhiệt độ không đổi, qua đó làm giảm thể tích đi một nửa và tăng từng nồng độ trên gấp đôi,
N2 = 6,56 × 10−3 mol lit−1,
H2 = 4,10 × 10−3 mol lit−1,
NH3 = 0,212 mol lit−1,
thì tỉ số giữa các sản phẩm chia cho chất phản ứng, hay hệ số phản ứng, sẽ không còn bằng Keq nữa:
Q = = 1,0 × 10−8 mol²lit−2.
Vì Q lớn hơn Keq, nên sẽ có dư nhiều phân tử sản phẩm để có thể đạt cân bằng. Phản ứng nghịch sẽ diễn ra tự phát, bằng cách đó sản sinh thêm NH3 và giảm các lượng H2 và N2. Hệ quả là, một phần áp suất tăng lên bị khấu trừ khi phản ứng dịch chuyển về hướng làm giảm tổng số mol khí có mặt. Nhìn chung, một phản ứng làm giảm số mol khí sẽ được ưa chuộng bởi sự tăng áp suất, còn phản ứng tạo thêm khí sẽ không được ưa chuộng. (Xem Hình 4-4.)
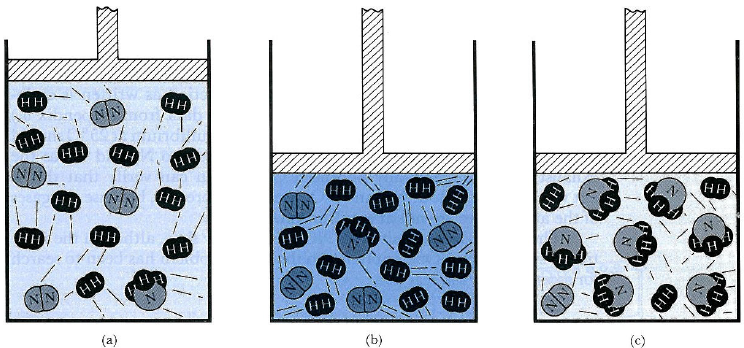
Hình 4-4 Nguyên lý Le Chatelier và áp suất. (a) Tại cân bằng ban đầu có 17 phân tử (mol) khí: 12 của H2, 4 của N2, và 1 của NH3. (b) Khi lượng khí này được nén về thể tích nhỏ hơn, thì đã hình thành một tác động, biểu hiện bởi áp suất cao hơn. (c) Tác động này có thể được giảm bớt và áp suất hạ xuống nếu một số phân tử của H2 và N2 kết hợp với nhau để tạo thêm NH3, vì bằng cách này số phân tử khí giảm đi. Từ tài liệu Dickerson and Geis, Chemistry, Matter, and the Universe.
Ví dụ 20
Nếu phản ứng hydro-iot nói trên được tiến hành trong điều kiện nhiệt độ mà iot ở thể rắn, thì liệu một sự tăng áp suất sẽ chuyển dịch phản ứng đang cân bằng về phía thêm HI, hay bớt? Ảnh hưởng của áp suất đối với Keq sẽ như thế nào?
Lời giải. Vì phản ứng 2 mol khí HI giờ đây chỉ cho ra 1 mol khí H2 và 1 mol I2 rắn, nên tác động của việc tăng áp suất đã được giảm bớt thông qua việc phân tách HI thành H2 và I2. Tuy nhiên, Keq vẫn sẽ không đổi qua việc tăng áp suất này.
Chất xúc tác
Một chất xúc tác có ảnh hưởng gì đối với phản ứng tại điểm cân bằng? Chẳng có gì cả. Một chất xúc tác không thể thay đổi giá trị của Keq, nhưng có thể tăng tốc độ đạt tới cân bàng. Đây chính là chức năng cơ bản của chất xúc tác. Nó chỉ có thể đưa phản ứng tới đúng đến trạng thái cân bằng có thể đạt tới mà không cần đến chất xúc tác đó.
Dù vậy, chất xúc tác vẫn hữu ích. Nhiều phản ứng mong muốn, dù là tự phát, song xảy ra ở tốc độ cực kì chậm trong điều kiện thường. Trong động cơ xe hơi, phản ứng chính tạo nên khói mù (smog) liên quan đến các oxit của ni-tơ là:
N2 + O2 ![]() 2NO
2NO
(Một khi NO đã có mặt, nó sẵn sang phản ứng với oxy dư để tạo nên NO2 màu nâu.) Ở nhiệt độ cao trong động cơ xe, Keq của phản ứng này quá lớn nên tạo thành lượng đáng kể NO. Tuy nhiên, ở 25ºC, Keq =10−30. (Chỉ dùng hai thông tin trên và nguyên lý Le Chatelier, hãy phán đoán xem liệu phản ứng này là thu nhiệt hay tỏa nhiệt. Hãy kiểm tra đáp án của bạn bằng cách dùng số liệu trong Phụ lục 3.) Lượng khí NO có trong khí quyển ở cân bằng tại 25ºC sẽ phải nhỏ đến mức không đáng kể. NO sẽ phân tách một cách tự phát thành N2 và O2 khi khí xả nguội đi. Nhưng ai cũng có thể kiểm tra khẳng định rằng điều này không xảy ra. Thực tế là có cả NO và NO2 cùng tồn tại, vì các khí trong khí quyển thì không phải ở điều kiện cân bằng.
Tốc độ phân tách NO cực kì chậm, dù rằng phản ứng là tự phát. Một giải pháp cho bài toán tạo khói mù là đi tìm chất xúc tác cho phản ứng
2NO ![]() N2 + O2
N2 + O2
mà có thể được tiến hành trong hệ thống xả, và có thể phá vỡ NO trong khí xả khi chúng nguội đi. Việc tìm chất xúc tác là có thể; song vấn đề đặt ra là sự nhiễm độc dần dần của chất xúc tác này bởi những phụ gia xăng, như các hợp chất chứa chì. Đây là lý do tại sao mà những xe mới có bộ chuyển đổi xúc tác đều chỉ dùng xăng không pha chì.

Hình 4-5 Động cơ vĩnh cửu ammoniac. Một hỗn hợp chứa NH3, H2, và N2 được chứa trong ngăn giữ bởi pit tông phía trái, và một xi lanh (được vẽ gạch chéo) treo lơ lửng bên trái của một cần chứa một loại chất xúc tác ảo tưởng; chất này có thể đẩy dịch cân bằng của phản ứng 2NH3(k) ![]() N2(k) + 3H2(k) sang phải. Trong (a) và (b), khi chất xúc tác này được đưa vào, ammonia đã phân tách thành ni tơ và hydro. Tổng thể tích khí tăng lên và pit tông được đẩy sang bên phải. Trong (c) và (d), khi chất xúc tác được rút ra ngoài, N2 và H2 kết hợp lại để tạo thành ammoniac; theo đó thể tích co lại và pit tông dịch về bên trái. Quá trình hai giai đoạn khép kín này cung cấp ra nguồn công vô hạn cho bánh xe phía phải, mà không phải cung cấp năn lượng từ bên ngoài. Hãy đọc phần giải thích kèm theo đây để biết được những khó khăn nảy sinh trong thực tế.
N2(k) + 3H2(k) sang phải. Trong (a) và (b), khi chất xúc tác này được đưa vào, ammonia đã phân tách thành ni tơ và hydro. Tổng thể tích khí tăng lên và pit tông được đẩy sang bên phải. Trong (c) và (d), khi chất xúc tác được rút ra ngoài, N2 và H2 kết hợp lại để tạo thành ammoniac; theo đó thể tích co lại và pit tông dịch về bên trái. Quá trình hai giai đoạn khép kín này cung cấp ra nguồn công vô hạn cho bánh xe phía phải, mà không phải cung cấp năn lượng từ bên ngoài. Hãy đọc phần giải thích kèm theo đây để biết được những khó khăn nảy sinh trong thực tế.
Một lời chứng minh rằng chất xúc tác không thể thay đổi hằng số cân bằng được minh họa trên Hình 4-5. Nếu một chất xúc tác có thể dịch chuyển điểm cân bằng của một hỗn hợp khí phản ứng và tạo nên sự thay đổi về thể tích, thì việc giãn hoặc nén này có thể thực hiện được bằng phương tiện cơ giới và tạo ra công. Như thế ta sẽ có một động cơ vĩnh cửu có thể phát công suất mà không cần nguồn năng lượng. Từ hiểu biết chung cùng thực tiễn, ta biết rằng điều này không thể xảy ra. Chính “chiểu biết chung” này được diễn đạt một cách khoa học dưới dạng định luật I về nhiệt động học, mà ta sẽ bàn luận ở Chương 15. Về toán học, việc làm trên được gọi là phản chứng: Nếu ta giả sử rằng một chất xúc tác có thể làm thay đổi Keq, thì ta phả giả thiết rằng động cơ vĩnh cửu này tồn tại. Tuy nhiên, một động cơ vĩnh cử như thế không bao giờ có được; bởi vậy giả thiết ban đầu của ta là sai, và ta phải kết luận rằng chất xúc tác không thể làm thay đổi Keq được.
Nói tóm lại, Keq là một hàm số phụ thuộc vào nhiệt độ, nhưng không phải là hàm số phụ thuộc các nồng độ chất tham gia hay sản phẩm, áp suất tổng cộng, hay sự có mặt/vắng mặt của chất xúc tác. Các lượng tương đối của các chất tại điểm cân bằng có thể được thay đổi bằng cách đặt tác động ngoài lên hỗn hợp cân bằng của các chất tham gia cùng sản phẩm, và sự thay đổi chính là để giảm nhẹ tác động này. Luận điểm trên, nguyên lý Le Chatelier, cho phép ta phán đoán xem điều gì sẽ xảy ra với một phản ứng khi các nhân tố bên ngoài thay đổi, mà ta không phải thực hiện tính toán chính xác.
Tóm tắt
Một phản ứng tự phát là phản ứng sẽ xảy ra không cần sự trợ giúp từ bên ngoài, miễn là có đủ thời gian thực hiện. Có những phản ứng tự phát diễn ra nhanh chóng, song thời gian không phải là yếu tố cấu thành định nghĩa cho tính tự phát. Một phản ứng có thể chận gần như vô tận song vẫn được coi là tự phát.
Phản ứng tổng hợp mà ta quan sát thấy chính là kết quả của sự tương tranh giữa các bước thuận và nghịch. Nếu như quá trình thuận diễn ra nhanh hơn, thì các sản phẩm sẽ tích tụ lại, và ta nói rằng phản ứng là tự phát theo chiều thuận. Nếu quá trình nghịch nhanh hơn, thì các chất tham gia sẽ tích tụ lại, và ta nói rằng phản ứng nghịch là tự phát. Nếu cả hai quá trình thuận và nghịch đều xảy ra với tốc độ như nhau, thì không có thay đổi tổng hợp nào được quan sát thấy với bất kì chất nào của phản ứng. Đây là trạng thái cân bằng hóa học.
Tỉ số giữa tích các chất tham gia, mỗi lượng nồng độ được nâng lên lũy thừa tương ứng với hệ số của chất đó trong phân trình phản ứng cân bằng, thì được gọi là hằng số cân bằng, Keq. (Xem phương trình 4-8.) Hằng số này có thể được dùng để ước tính xem liệu một phản ứng dưới những điều kiện cụ thể sẽ là tự phát hay không, và để tính nồng độ của các chất tham gia lẫn sản phẩm tại điểm cân bằng. Hệ số phản ứng, Q, có dạng công thức giống như với hằng số cân bằng, Keq, nhưng Q cũng áp dụng được với các điều kiện không cân bằng. Với một điều kiện cho trước, nếu Q nhỏ hơn Keq, thì phản ứng thuận là tự phát; nếu Q lớn hơn Keq, thì phản ứng nghịch là tự phát; còn nếu Q = Keq, thì hệ thống đang ở điểm cân bằng.
Hằng số cân bằng có thể được dùng với một hệ đơn vị đo nồng độ tiện dụng bất kì: mol lit−1, áp suất tính theo atmotphe, hay các đơn vị khác. Trị số của nó sẽ phụ thuộc vào các đơn vị nồng độ, bởi vậy ta phải cẩn thận để khớp các giá trị đúng của Keq với đơn vị khi giải toán. Nếu nồng độ khí được biểu diễn bởi mol lit−1, thì hằng số cân bằng sẽ được ghi là Kc; nếu biểu diễn theo atmotphe, thì là Kp. Cũng như áp suất riêng phần của thành phần thứ j trong một hỗn hợp khí được liện hệ với mol trên lít bởi biểu thức pj = cjRT, thì Kp và Kc được liên hệ bởi Kp = Kc(RT)Δn, trong đó Δn là độ thay đổi tổng hợp theo số mol khí trong quá trình phản ứng.
Khi có (các) chất tham gia và sản phẩm phản ứng là những chất rắn hoặc lỏng tinh khiết, thì chúng đóng vai trò như những kho cung cấp hóa chất vô hạn miễn là còn chất rắn hoặc chất lỏng. Hiệu ứng của chúng đối với điểm cân bằng chỉ phụ thuộc vào sự có mặt của chúng, chứ không phụ thuộc vào lượng chất có mặt. Nồng độ hiệu quả của chúng là hằng số, và có thể được gộp vào trong Keq. Khi tính toán, điều này đơn giản là ta bỏ qua các đại lượng nồng độ cho chất rắn và lỏng tinh khiết khỏi biểu thức hằng số cân bằng. Sự bốc hơi của một chất lỏng có thể được biểu diễn một cách chặt chẽ như một phản ứng hóa học trong đó chất tham gia là chất lỏng và sản phẩm là hơi. Quy ước này đối với việc viết những lượng nồng độ một chất lỏng cho phép ta viết hằng số cân bằng cho quá trình bốc hơi dưới dạng Kp = pj, trong đó pj là áp suất hơi cân bằng đối với chất j.
Nguyên lý Le Chatelier phát biểu rằng nếu như tác động được đặt lên một hệ thống tại điểm cân bằng thì lượng các chất tham gia và phản ứng sẽ dịch chuyển sao cho giảm thiểu tác động đó. Điều này nghĩa rằng, với một phản ứng thu nhiệt, Keq sẽ tăng khi nhiệt độ tăng, vì việc tiến hành phản ứng là một cách để hấp thụ phần nào lượng nhiêt mới bổ sung. Tương tự như vậy, việc làm nguyệt sẽ tăng Keq với một phản ửng tỏa nhiệt. Mặc dù hằng số cân bằng Keq độc lập với áp suất, và việc thay đổi tổng áp suất lên một hệ phản ứng không làm thay đổi trực tiếp Keq, nhưng một thay đổi về áp suất vẫn làm cho phản ứng dịch chuyển theo hướng làm giảm tổng số mol khí có mặt.
Một chất xúc tác không hề có ảnh hưởng gì đến Keq hay các điều kiện cân bằng. Tất cả những gì mà chất xúc tác có thể làm là khiến cho hệ đạt đến cân bằng nhanh hơn so với khi không có nó. Chất xúc tác có thể làm những phản ứng với bản chất tự phát nhưng chậm trở nên phản ứng nhanh hơn, nhưng nó không thể làm cho những phản ứng không tự phát trở nên tự diễn ra được.
Câu hỏi tự học
- Phản ứng tự phát là gì? Có nhất thiết là phản ứng tự phát phải nhanh chóng không? Hãy lấy ví dụ minh họa khác với những ví dụ đã có trong chương này.
- Chất xúc tác có ảnh hưởng thế nào tới phản ứng tự phát? Chất xúc tác có tác dụng gì đối với điểm cân bằng trong một phản ứng?
- Hằng số tốc độ của phản ứng hóa học có ý nghĩa là gì? Hằng số cân bằng là gì? Hằng số cân bằng phụ thuộc thế nào vào các nồng độ của các chất tham gia và sản phẩm phản ứng? Nó phụ thuộc thế nào vào số tương đối các phân tử trong phản ứng hóa học?
- Về nguyên tắc, hằng số cân bằng của phản ứng hóa học liên hệ thế nào đến các hằng số tốc độ thuận và nghịch? Các biểu thức hằng số tốc độ với những phản ứng thuận và nghịch có thể được xây dựng chỉ dựa trên phản ứng hóa học tổng cộng đã cân bằng hay không? Tại sao? Có thể xây dựng biểu thức hằng số cân bằng có thể được xây dựng chỉ trên cơ sở phản ứng tổng cộng đã cân bằng hay không? Tại sao?
- Biểu thức hằng số cân bằng sẽ thay đổi thế nào nếu như tất cả các lượng trong một phản ứng hóa học cân bằng (hệ số) được gấp đôi lên? Biểu thức trên thay đổi thế nào nếu các lượng này giảm đi một nửa? Nếu viết phản ứng theo chiều ngược lại thì sẽ ảnh hưởng thế nào đến hệ số cân bằng?
- Hệ số phản ứng là gì, và nó liên hệ thế nào đến hằng số cân bằng? Làm cách nào mà việc so sánh hai đại lượng trên cho phép ta quyết định được liệu một phản ứng dưới điều kiện cho trước là phản tự phát, tự phát theo chiều nghịch, hay ở điểm cân bằng?
- Trị số của hằng số cân bằng phụ thuộc thế nào vào cách chọn đơn vị biểu diễn các nồng độ? Đối với chất khí, ta có thể chuyển đổi từ áp suất riêng phần sang mol lit−1 như thế nào? Kp và Kc có liên hệ thế nào?
- Với những loại phản ứng nào thì hằng số cân bằng là một số không đơn vị? Khi đó Kp và Kc có mối liên hệ thế nào?
- Tại sao ta hoàn toàn có thể bỏ qua những lượng nồng độ khỏi biểu thức hằng số cân bằng với những chất rắn hoặc lỏng tinh khiết?
- Có thể dùng khái niệm hằng số cân bằng để giải thích áp suất hơi như thế nào?
- Nguyên lý Le Chatelier là gì? Nó giúp ta dự đoán kết quả của sự thay đổi nhiệt độ đối với phản ứng hóa học thế nào?
- Nguyên lý Le Chatelier có thể giải thích hiệu ứng của thay đổi áp suất đối với cân bằng hóa học như thế nào?
- Chất xúc tác sẽ làm thay đổi Keq thế nào? Giải thích câu trả lời của mình bằng cách chỉ dẫn đến sự tồn tại hay không của những động cơ vĩnh cửu. Tại sao chất xúc tác lại hữu ích?
Bài tập
Biểu thức cân bằng
- Hãy viết các biểu thức hằng số cân bằng cho những phản ứng sau:
a) 2H2S(k) 2H2(k) + S2(k)
2H2(k) + S2(k)
b) 2H2S(k) 2H2(k) + 2S(r)
2H2(k) + 2S(r)
c) PCl3(k) + Cl2(k) PCl5(k)
PCl5(k)
d) Na2CO3(r) Na2O(r) + CO2(k)
Na2O(r) + CO2(k)
e) 2NO2(k) 2NO(k) + O2(k)
2NO(k) + O2(k) - Hãy viết các biểu thức hằng số cân bằng cho những phản ứng sau:
a) 4NH3(k) + 7O2(k) 4NO2(k) + 6H2O(k)
4NO2(k) + 6H2O(k)
b) 2NO2(k) + 7H2(k) 2NH3(k) + 4H2O(l)
2NH3(k) + 4H2O(l)
c) NH4Cl(r) NH3(k) + HCl(k)
NH3(k) + HCl(k)
d) H2(k) + (CN)2(k) 2HCN(k)
2HCN(k)
e) 2ZnS(r) + 3O2(k) 2ZnO(r) + 2SO2(k)
2ZnO(r) + 2SO2(k) - Hãy viết các biểu thức hằng số cân bằng cho những phản ứng sau:
a) N2O4(k) 2NO2(k)
2NO2(k)
b) N2O4(k) N2(k) + 2O2(k)
N2(k) + 2O2(k)
c) 2NO2(k) N2O4(k)
N2O4(k)
d) NO2(k) ½N2O4(k)
½N2O4(k)
e) N2O5(r) 2NO2(k) + ½O2(k)
2NO2(k) + ½O2(k) - Hãy viết các biểu thức hằng số cân bằng cho những phản ứng sau:
a) Cl2(k) + H2O(k) 2HCl(k) + ½O2(k)
2HCl(k) + ½O2(k)
b) HCl(k) + ½O2(k) ½Cl2(k) + ½H2O(k)
½Cl2(k) + ½H2O(k)
c) 4HCl(k) + O2(k) 2Cl2(k) + 2H2O(l)
2Cl2(k) + 2H2O(l)
d) C(r) + CO2(k) 2CO(k)
2CO(k)
e) NH4SH(r) NH3(k) + S(r) + H2(k)
NH3(k) + S(r) + H2(k)
Kp và Kc
- 5. Ở 1476 K, hệ số cân bằng cho phản ứng
CO(k) + ½O2(k) CO2(k)
CO2(k)
được cho bởi Kp = 2,5 × 105.
a) Những đơn vị nào là hợp lý (theo atmotphe) cho giá trị Kp viết ở trên?
b) Trị số của Kp với phản ứng dưới đây bằng bao nhiêu?
2CO2(k) 2CO(k) + O2(k)
2CO(k) + O2(k)
Các đơn vị của Kp này là gì?
c) Trị số của Kc cho phản ứng thuận trên là gì, và đơn vị của nó như thế nào?
d) Trong một hỗn hợp cân bằng ba thứ khí kể trên, CO2 và CO hiện diện với số mol bằng nhau. Khi đó, nồng độ của O2 theo atmotphe, và theo mol lit−1 bằng bao nhiêu?
- 6. Ở 1476 K, hệ số cân bằng cho phản ứng
C(r) + CO2(k) 2CO(k)
2CO(k)
được cho bởi Kp = 1,67 × 103.
a) Những đơn vị nào là hợp lý (theo atmotphe) cho giá trị Kp viết ở trên?
b) Trị số của Kc cho phản ứng thuận trên là gì, và đơn vị của nó như thế nào?
c) Dạng toán học của biểu thức hằng số cân bằng cho phản ứng sau ra sao?
C(r) + O2(k) CO2(k)
CO2(k)
d) Trị số của Kp trong phản ứng ngay trên là bao nhiêu? (Một thông tin quan trọng nhưng còn thiếu đã cho ở Bài số 5.)
e) Mục d đã gợi ý nguyên lý chung gì, về biểu thức hằng số cân bằng cho tổng cộng hai phản ứng?
Hệ số phản ứng
7. Hằng số cân bằng cho phản ứng
N2(k) + O2(k) ![]() 2NO(k)
2NO(k)
ở 2130ºC thì bằng 2,5 × 10−3. Tại sao không cần nói thêm rằng giá trị này là Kp hay Kc ? Phản ứng nêu trên hấp thụ nhiệt. Theo các điều kiện sau, hãy xác định xem liệu phản ứng là tự phát theo chiều thuận hoặc nghịch, hay liệu nó ở tại điểm cân bằng:
a) Một hộp 1 lít chứa 0,02 mol NO, 0,01 mol O2, và 0,02 mol N2 ở 2130ºC.b) Một hộp 20 lít chứa 0,01 mol N2, 0,001 mol O2, và 0,02 mol NO ở 2130ºC.
c) Một hộp 1 lít chứa 1,00 mol N2, 16 mol O2, và 0,2 mol N2 ở 2500ºC.
8. Khí brom nitrosyl, NOBr, được tạo thành qua phản ứng
2NO(k) + Br2(k) ![]() 2NOBr(k)
2NOBr(k)
Ở 25ºC, hằng số cân bằng cho phản ứng này là Kp = 116 atm−1. Phản ứng như đã viết thuộc loại tỏa nhiệt. Khi các lượng sau đây của ba khí được đưa vào trong một bình 1 lít, thì liệu phản ứng là tự phát theo chiều thuận/nghịch, hay ở tại điểm cân bằng?
a) 0,045 atm NOBr, 0,01 atm NO, và 0,10 atm Br2 ở 25ºC.
b) 0,045 atm NOBr, 0,01 atm NO, và 0,01 atm Br2 ở 25ºC.
c) 0,108 atm NOBr, 0,01 atm NO, và 0,01 atm Br2 ở 0ºC.
Tính toán Keq
9. Khi phản ứng lưu huỳnh trioxit được tiến hành ở 1000 K, một mẫu hỗn hợp khí cân bằng có 0,562 atm SO2, 0,101 atm O2, và 0,332 atm SO3. Hãy tính hằng số cân bằng, Kp, cho việc tạo ra 1 mol SO3 từ SO2 và O2. Tính Kp cho việc phân tách 2 mol SO3 thành 1 mol O2 và 2 mol SO2. Hai hằng số cân bằng nói trên có liên hệ thế nào với nhau?
10. Nếu CO2 tinh khiết được đặt vào một bình kín và nhiệt độ được nâng lên đến 2000 K, thì lượng CO2 này sẽ có 1,6% phân tách thành CO và O2; nghĩa là trong mỗi 1000 phân tử CO2 ban đầu, sẽ có 16 phân tách thành CO và 984 giữ nguyên là CO2. Coi như tất cả O2 trong đó đều là do sự phân tách này, và áp suất tổng là 1 atm, hãy tính Kp và Kc cho phản ứng:
CO2(k) ![]() CO(k) + 1/2 O2(k)
CO(k) + 1/2 O2(k)
11. 3,00 mol NO, 5,00 mol ClNO, và 2,00 mol Cl2 được đặt vào trong một bình 25 lít ở nhiệt độ 503 K. Sau khi phản ứng đã đạt đến cân bằng, có 6,12 mol ClNO trong bể.
a) Hãy viết phương trình cân bằng cho phản ứng tạo ra 1 mol ClNO từ hai thành phần kia.
b) Hãy tính Kp và Kc cho phản ứng này ở 503 K, với đơn vị thích hợp cho từng phản ứng.
12. Nếu cacbon đi oxit được đưa qua một nền rải graphit ở 1050ºC, thì luồng khí sản phẩm (coi như ở cân bằng) sẽ có 0,74% mol CO2 và 99,26% mol CO.
a) Hãy viết một phương trình cân bằng cho sự tạo thành 2 mol CO từ cacbon và CO2.
b) Nếu áp suất tổng là 2,00 atm, hãy tính Kp và Kc cho phản ứng.
Các nồng độ tại điểm cân bằng
13. Thí nghiệm cho thấy rằng ở 60ºC và 1 atm áp suất tổng cộng, thì tỉ lệ cân bằng của NO2 so với N2O4 theo mol trong một bình kín đúng bằng 2:1.
a) Hãy tính hằng số cân bằng, Kc, cho sự phân tách 1 mol N2O4 thành 2 mol NO2.
b) Bằng cách đo cường độ màu nâu của NO2, người làm thí nghiệm đã xác định rằng 0,30 mol NO2 có mặt trong một bình 1 lít ở đó cân bằng đã được thiết lập với N2O4 ở 60ºC. Hãy tính số mol N2O4 có mặt.
14. Hằng số cân bằng cho phản ứng 2HCl(k) ![]() H2(k) + Cl2(k) ở 25ºC là 6,2 × 10−54.
H2(k) + Cl2(k) ở 25ºC là 6,2 × 10−54.
a) Không cần phải tính, dựa vào giá trị của hằng số này mà bạn biết được gì về sự phân tách HCl?
b) Hãy tính nồng độ theo mol lit−1 của khí hydro ở cân bằng với 0,010 mol HCl trong bình 1 lít, với giả sử rằng ban đầu bình được chứa đầy HCl tinh khiết.
c) Nếu 0,0050 mol Cl2 và 0,0050 mol H2 được đặt cùng nhau trong một bình 1 lít và được phép đạt tới cân bằng ở 25ºC, thì nồng độ cuối cùng của khí Cl2 tính theo mol lit−1 bằng bao nhiêu? (Nếu bạn gặp khó khăn, hãy so sánh phần này với phần b.)
15. Hằng số cân bằng cho phản ứng là Keq = 5,10 ở 800 K. Các đơn vị cho Keq này như thế nào, và giá trị của nó so với Kp và Kc ra sao? Hãy giải thích kết quả so sánh trên. Nếu một bình được bơm đầy 1 atm CO và 10,00 atm H2O, rồi các khí này được cho đạt tới cân bằng, thì khi đó các áp suất riêng phần của H2 và của H2O sẽ bằng bao nhiêu?
16. Phản ứng SO2(k) + ½O2(k) ![]() SO3(k)
SO3(k)
có hằng số cân bằng là 33,4 atm−1/2 ở 530ºC. Hãy tính tổng áp suất trong một bình phản ứng đã được nạp 10,00 atm từng khí SO2 và O2, vốn sau đó được đưa tới cân bằng. (Bài toán này đơn giản về mặt nguyên lý, nhưng yêu cầu sử dụng khéo léo phương pháp gần đúng liên tiếp để tránh phải giải phương trình bậc ba.)
Cân bằng dị thể
17. Sự phân tách canxi cacbonat, SO2(k) + ½O2(k) ![]() SO3(k)
SO3(k)
ở 1013 K thì có hằng số cân bằng là Kc = 0,0060. Nếu như nồng độ được đo bằng mol lit−1, thì các đơn vị của Kc này là gì? Coi như 0,100 mol canxi cacbonat được đặt vào trong một bình 10 lít ở 1013 K; hãy tính các giá trị cân bằng của
a) Nồng độ CO2 tính theo mol lit−1
b) Số mol CO2 có mặt trong bình
c) Phần tỉ lệ canxi cacbonat ban đầu đã được chuyển hóa thành canxi oxit.
d) Áp suất của cacbon dioxit trong bình.
18. Ở 613 K, Kc = 0,064 đối với phản ứng Fe2O3(r) + 3H2(k) ![]() 2Fe(r) + 3H2O(k)
2Fe(r) + 3H2O(k)
a) Các đơn vị của Kc là gì?
b) Nếu như phản ứng này được thực hiện theo cách mà áp suất riêng phần của hydro tại cân bằng là 1,00 atm, thì nồng độ của hydro tính theo mol lit−1 sẽ bằng bao nhiêu?
c) Nồng độ của hơi nước tại cân bằng, tính theo mol lit−1 và theo atmotphe bằng bao nhiêu?
Nguyên lý Le Chatelier
19. Ở nhiệt độ phòng, hằng số cân bằng Kp cho sự phân tách N2O4 thành NO2 là 5,83 × 10−3, và ở 10ºC cao hơn nhiệt độ phòng thì là 1,26 × 10−2. Liệu sự phân tách N2O4 là thu nhiệt hay tỏa nhiệt? Bạn xác định điều này bằng cách nào?
20. Nhiệt của phản ứng 2NO(k) ![]() N2(k) + O2(k) là ΔH298 = 180 kJ.
N2(k) + O2(k) là ΔH298 = 180 kJ.
a) Nitric oxit, NO, sẽ bền hơn ở nhiệt độ cao hay thấp?
b) Trong thự tế, nitric oxit phân tách nhanh hơn ở nhiệt độ cao. Vì sao điều này không thống nhất với câu trả lời phần a của bạn?
21. Phản ứng sau đây là thu nhiệt: PCl3(k) + Cl2(k) ![]() PCl5(k)
PCl5(k)
Hỏi mỗi sự xáo trộn sau đây sẽ gây ảnh hưởng thế nào đến cân bằng?
a) Làm tăng áp suất tổng
b) Thêm vào các lượng mol bằng nhau của PCl3 và PCl5, ở thể tích không đổi
c) Thêm vào khí clo ở thể tích không đổi
d) Giãn gấp đôi thể tích
e) Tăng nhiệt độ.
22. Ở 25ºC và 20 atm, phản ứng N2(k) + 3H2(k) ![]() 2NH3(k)
2NH3(k)
có ΔH là –92,5 kJ. Mỗi sự thay đổi sau đây sẽ có ảnh hưởng như thế nào đến cân bằng?
a) Tăng nhiệt độ lên 300ºC đồng thời vẫn giữ áp suất ở 20 atm.
b) Tăng áp suất lên đến 30 atm đồng thời vẫn giữ nhiệt độ ở 25ºC.
c) Lấy đi một nửa lượng amoniac và cho phép hệ trở lại cân bằng một lần nữa.
d) Bổ sung chất xúc tác là Cr2O3 để tổng hợp nên amoniac.
Tài liệu cần tìm đọc
A. J. Bard, Chemical Equilibrium, Harper & Row, New York, 1966.
M. J. Sienko, Chemistry Problems, W.A. Benjamin, Menlo Park, Calif., 1972, 2nd ed.
Đáp số
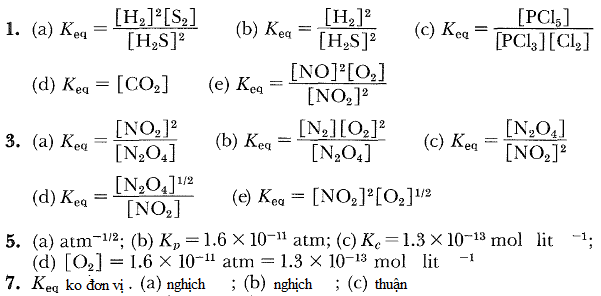



Pingback: Những nguyên lý hóa học | Blog của Chiến
nguyên nhân cùa CBHH là gì, giúp mình nha
Mình không nói được một cách bài bản nhưng cân bằng phải dựa trên số nguyên tử của từng nguyên tố trong các thành phần chất tham gia và sản phẩm.